Le cyanure est une substance toxique dangereuse, potentiellement mortelle à fortes doses. Voici des informations essentielles sur ce poison :
Le cyanure peut exister sous forme gazeuse, liquide et solide. C’est une substance incolore qui dégage une odeur rappelant celle des amandes amères, mais cette odeur n’est pas perceptible par tous.
Le terme « cyanure » désigne un groupe de composés chimiques contenant une liaison carbone-azote (CN). Certaines formes sont hautement toxiques et peuvent entraîner la mort, notamment :
- Forme gazeuse: Chlorure de cyanogène (CNCl)
- Forme solide: Cyanure de sodium (NaCN) et cyanure de potassium (KCN)
- Forme liquide: Acide cyanhydrique ou cyanure d’hydrogène (HCN)
Le cyanure agit rapidement en empêchant le corps d’utiliser l’oxygène, causant des dommages aux organes vitaux. Voici quelques propriétés chimiques de ce composé :
- Le cyanure est le sel de l’acide cyanhydrique, un acide plus faible que l’acide carbonique (H2CO3). Il est donc facilement déplacé de ses sels par des acides plus forts.
- Formule chimique: 2NaCN + H2SO4 → Na2SO4 + 2HCN
- Le cyanure réagit avec l’oxygène de l’air pour former du cyanate.
- Formule chimique: 2CN- + O2 → 2CNO-
- En solution diluée à 1‰, le HCN se décompose complètement en environ 5 mois.
- Formule chimique: HCN + 2H2O → HCOONH4 et 2HCN + 2H2S + O2 → 2HCNS + 2H2O
- Le cyanure de métal alcalin est décomposé par le CO2 de l’air et forme du HCN.
- Formule chimique: 2NaCN + CO2 + H2O → 2HCN + Na2CO3
- Les sels de cyanure sont solubles dans l’eau et se lient facilement au cyanure insoluble pour former des ions complexes. L’acide nitrique (HNO3) peut réagir avec des substances organiques comme les acides malique, citrique, les alcaloïdes et les tanins pour produire du cyanure d’hydrogène (HCN). Ceci explique la formation de glucosides cyanhydriques chez certaines plantes.
- Les aldéhydes (composés présents dans l’alcool) et les sucres peuvent également détruire la structure du HCN.
- Formule chimique: C6H12O6 + HCN → C7H13O6N
- Des dérivés organiques de l’acide cyanhydrique (HCN) se trouvent dans certaines plantes comme les amandes amères, les noyaux de prunes, les racines de manioc, les pousses de bambou… Par exemple, l’amygdaline (C20H27NO11 – substance chimique naturelle présente dans certaines plantes) contenue dans l’huile d’amande amère libère du HCN lors de son hydrolyse.
- Formule chimique: C20H27NO11 + 2H2O → C7H6O + 2C6H12O6 + HCN

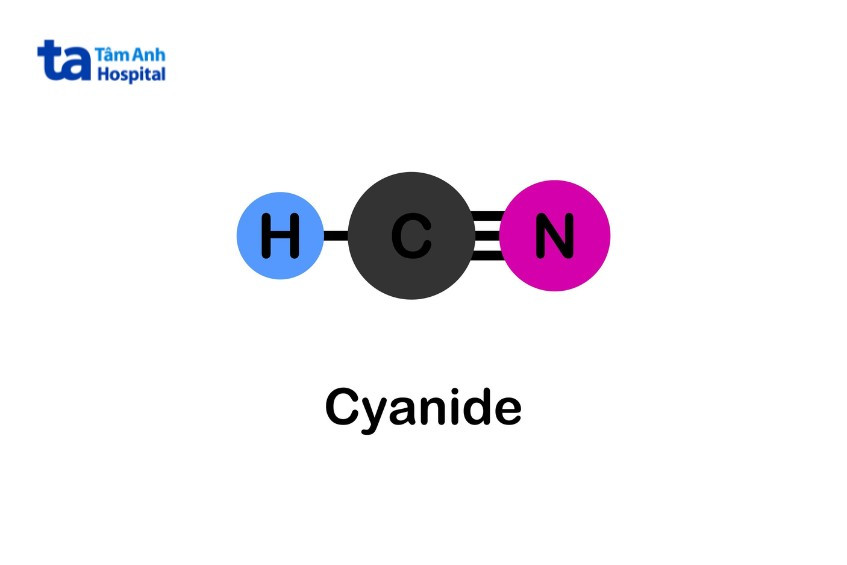




Le cyanure est basique, le pKa du cyanure d’hydrogène étant de 9,1. Par conséquent, l’ajout d’un acide fort à une solution de sel de cyanure libère du cyanure d’hydrogène. Ce composé subit une hydrolyse pour former de l’ammoniac (NH3) et du formiate (HCOO-). Ces produits sont moins toxiques que le cyanure initial.
- Formule chimique: CN- + 2 H2O → HCOO- + NH3
L’anion cyanure est un nucléophile puissant, permettant aux groupes cyanure de remplacer facilement les halogénures dans les molécules organiques. En chimie organique, le cyanure est un synthon C-1 utilisé pour allonger les chaînes carbonées tout en conservant la fonctionnalité.
- Formule chimique: RX + CN- → RCN + X-
L’ion cyanure est un agent réducteur et peut être oxydé par des oxydants puissants tels que le chlore (Cl2), l’hypochlorite (CIO-) et le peroxyde d’hydrogène (H2O2). Dans l’extraction de l’or, ces oxydants sont utilisés pour décomposer le cyanure toxique dans les eaux usées, protégeant ainsi l’écosystème de la pollution.
L’anion cyanure réagit avec les métaux de transition pour former des liaisons M-CN (cyanométallates), réaction à la base de la toxicité du cyanure. La forte affinité des métaux pour cet anion peut être attribuée à sa charge négative, sa compacité et sa capacité à former des liaisons π.
Le procédé d’Andrussow est le principal mode de production du cyanure. Le cyanure gazeux est produit à partir de méthane (CH4) et d’ammoniac (NH3) en présence d’oxygène et d’un catalyseur au platine.
- Formule chimique: 2CH4 + 2NH3 + 3O2 → 2HCN + 6H2O
Le cyanure de sodium, précurseur de la plupart des composés cyanurés, est produit par la réaction de l’hydroxyde de sodium avec le cyanure d’hydrogène.
- Formule chimique: HCN + NaOH → NaCN + H2O
Malgré sa toxicité extrême, le cyanure est utilisé dans divers domaines :
Ce poison permet de dissoudre et de séparer l’or et l’argent des autres impuretés. Dans le processus de cyanuration des minerais, le minerai d’or (pureté de 75% à 95%) est finement broyé et mélangé à du cyanure dans un rapport de 1:1500. Pour les métaux aurifères, ils sont empilés et pulvérisés avec une solution de cyanure dans un rapport de 1:1000.
L’or est généralement complexé par l’ion cyanure pour former des dérivés solubles tels que (Ag(CN)2) et (Au(CN)2). L’argent est souvent trouvé sous forme de sulfure, auquel cas aucune réaction d’oxydoréduction n’est nécessaire, mais plutôt une réaction de substitution selon la formule chimique suivante :
- Ag2S + 4 NaCN + H2O → 2 Na(Ag(CN)2) + NaSH + NaOH
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na(Au(CN)2) + 4 NaOH
Le cyanure peut être utilisé pour produire des composés contenant du CN, généralement des nitriles. Les acyl cyanures sont produits à partir d’acyles et de cyanure. Le cyanogène ((CN)2), le chlorure de cyanogène (CNCl) et le chlorure de cyanurique trimère ((NCCl)3) sont dérivés de cyanures de métaux alcalins.
Le nitroprussiate de sodium (SNP), un composé de cyanure, est utilisé en chimie clinique pour mesurer les corps cétoniques dans l’urine (sous-produits de la décomposition des acides gras), principalement pour surveiller la glycémie chez les diabétiques et les femmes enceintes. Il est parfois utilisé pour abaisser la tension artérielle en urgence et comme vasodilatateur dans les études vasculaires. De plus, ce composé peut aider à traiter la tuberculose et la lèpre.
Dans certaines régions, le cyanure est utilisé pour exterminer les insectes, les fourmis et les rats. Cependant, son utilisation nécessite une autorisation et un dosage précis pour éviter tout risque pour la santé humaine et l’environnement.
À faibles doses, le cyanure peut embellir les sculptures en bronze grâce à sa capacité à créer une teinte bleue. Il est également utilisé dans la fabrication de bijoux et en photographie. De plus, c’est un composant important dans la production de papier, de tissus et de plastiques. Cependant, lors de ces travaux spécifiques, il est crucial de porter un équipement de protection adéquat pour éviter l’intoxication au cyanure.
Dans l’industrie alimentaire, il peut être utilisé pour produire certains additifs.
Le cyanure est un composé polyvalent qui influence de nombreux domaines de la vie, de l’industrie à l’agriculture et aux services. Utilisé correctement, il peut contribuer à améliorer la qualité de vie et le développement socio-économique. Le cyanure est une substance difficile à identifier par son odeur ou son goût et provient de diverses sources :
Dans la nature, le cyanure est présent dans l’air, l’eau et les roches. On le trouve également dans certains aliments comme les amandes, le soja, les pousses de bambou fraîches, le manioc frais, les pommes, les prunes et les pêches.
Le groupement cyanure (un groupement de formule moléculaire CN) a été détecté dans l’espace interstellaire. Le cyanogène (CN)2 est utilisé pour mesurer la température des nuages interstellaires.
Le cyanure d’hydrogène (H−C≡N) est produit par la thermolyse ou la combustion de certains matériaux en conditions pauvres en oxygène, comme les gaz d’échappement des moteurs à combustion interne et la fumée de cigarette. De plus, le chauffage ou la combustion de certains plastiques, en particulier ceux dérivés de l’acrylonitrile (composé organique de formule CH2CHCN), libère du cyanure d’hydrogène.
Selon l’Union internationale de chimie pure et appliquée (UICPA), les composés organiques contenant le groupe fonctionnel −C≡N sont appelés nitriles, et les nitriles ne libèrent généralement pas d’ions cyanure. Un groupe hydroxyle −OH et un groupe cyanure −CN liés au même atome de carbone forment une cyanhydrine (R2C(OH)CN), qui peut libérer du HCN.