Zyanid ist ein gefährliches Gift, das bei hoher Dosis tödlich sein kann. Hier finden Sie Informationen zu diesem Giftstoff:
Zyanid kann in gasförmiger, flüssiger und fester Form vorliegen. Es ist farblos und riecht ähnlich wie Bittermandeln, aber nicht jeder kann diesen Geruch wahrnehmen.
Zyanid ist ein allgemeiner Begriff für Verbindungen, die eine Kohlenstoff-Stickstoff-Bindung (CN) enthalten. Einige hochgiftige und potenziell tödliche Formen sind:
- Gasförmig: Chlorcyan (CNCl)
- Fest: Natriumcyanid (NaCN) und Kaliumcyanid (KCN)
- Flüssig: Cyanwasserstoff oder Blausäure (HCN)
Zyanid wirkt sehr schnell und verhindert, dass der Körper Sauerstoff verwertet, was zu Schäden an lebenswichtigen Organen führt. Einige chemische Eigenschaften dieser Verbindung:
- Zyanid ist ein Salz der Blausäure, einer schwächeren Säure als Kohlensäure (H2CO3), und wird daher leicht von stärkeren Säuren aus ihren Salzlösungen verdrängt.
- Chemische Formel: 2NaCN + H2SO4 → Na2SO4 + 2HCN
- Zyanid reagiert mit Sauerstoff in der Luft zu Cyanat.
- Chemische Formel: 2CN- + O2 → 2CNO-
- In verdünnten Lösungen mit einer Konzentration von 1‰ zersetzt sich HCN innerhalb von etwa 5 Monaten vollständig.
- Chemische Formel: HCN + 2H2O → HCOONH4 und 2HCN + 2H2S + O2 → 2HCNS + 2H2O
- Alkalimetallcyanidsalze werden durch CO2 in der Luft zersetzt und bilden HCN.
- Chemische Formel: 2NaCN + CO2 + H2O → 2HCN + Na2CO3
- Cyanidsalze sind wasserlöslich und können sich leicht mit unlöslichem Cyanid verbinden, um komplexe Ionen zu bilden. Salpetersäure (HNO3) kann mit organischen Substanzen wie Äpfelsäure, Zitronensäure, Alkaloiden, Tanninen usw. reagieren, um Blausäure (HCN) zu erzeugen. Dies erklärt den Mechanismus der Bildung von cyanhydrischen Glucosiden in einigen Pflanzenarten.
- Aldehyde (in Alkohol enthaltene Verbindungen) und Zucker können ebenfalls die Struktur von HCN zerstören.
- Chemische Formel: C6H12O6 + HCN → C7H13O6N
- Organische Derivate der Blausäure (HCN) finden sich in einigen Pflanzenarten wie Bittermandeln, Pflaumenkernen, Maniokwurzeln, Bambussprossen usw. Amygdalin (C20H27NO11 – eine natürlich vorkommende Chemikalie in einigen Pflanzen) in Bittermandelöl setzt bei der Hydrolyse HCN frei.
- Chemische Formel: C20H27NO11 + 2H2O → C7H6O + 2C6H12O6 + HCN

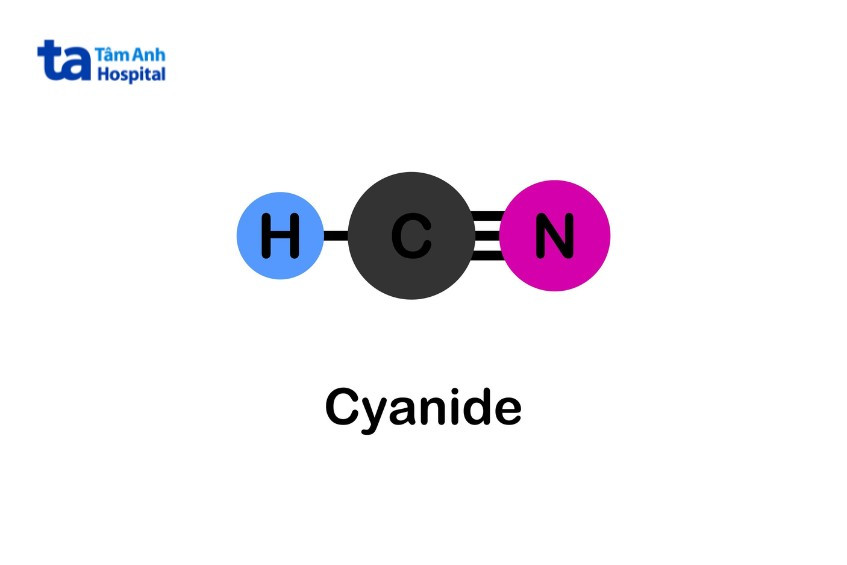




Zyanid ist basisch, der pKa-Wert von Blausäure beträgt 9,1. Daher wird bei Zugabe einer starken Säure zu einer Cyanidsalzlösung Blausäure freigesetzt. Diese Verbindung hydrolysiert zu Ammoniak (NH3) und Formiat (HCOO-). Im Vergleich zum ursprünglichen Cyanid sind diese Produkte weniger toxisch.
- Chemische Formel: CN- + 2 H2O → HCOO- + NH3
Das Cyanid-Anion ist stark nukleophil, daher können Cyanidgruppen leicht Halogenidgruppen ersetzen, um in organische Moleküle einzudringen. In organischen Mischungen ist Cyanid ein C-1-Synthon, das verwendet wird, um die Kohlenstoffkette zu verlängern, während seine Funktionen erhalten bleiben.
- Chemische Formel: RX + CN- → RCN + X-
Das Cyanid-Ion ist ein Reduktionsmittel und kann von starken Oxidationsmitteln wie Chlor (Cl2), Hypochlorit (CIO-) und Wasserstoffperoxid (H2O2) oxidiert werden. Im Goldbergbau werden diese Oxidationsmittel häufig verwendet, um toxisches Cyanid im Abwasser aufzulösen und das Ökosystem vor Verschmutzung zu schützen.
Das Cyanid-Anion reagiert mit Übergangsmetallen unter Bildung einer M-CN-Bindung (Cyanometallat), diese Reaktion ist die Grundlage der Cyanidtoxizität. Die hohe Affinität von Metallen zu dieser anionischen Form kann auf Faktoren wie negative Ladung, Kompaktheit und die Fähigkeit zur Beteiligung an π-Bindungen zurückzuführen sein.
Der Andrussow-Prozess ist das wichtigste Verfahren zur Herstellung von Cyanid. Dabei wird das Gift in gasförmiger Form aus Methan (CH4) und Ammoniak (NH3) in Gegenwart von Sauerstoff und einem Platinkatalysator hergestellt.
- Chemische Formel: 2CH4 + 2NH3 + 3O2 → 2HCN + 6H2O
Natriumcyanid ist die Vorstufe der meisten CN-Arten und wird durch die Reaktion von Natriumhydroxid mit Blausäure hergestellt.
- Chemische Formel: HCN + NaOH → NaCN + H2O
Obwohl es als hochgiftige Substanz bekannt ist, wird Zyanid in vielen Bereichen eingesetzt:
Dieses Gift hilft, Gold und Silber von anderen Verunreinigungen zu lösen und zu trennen. Beim Cyanidlaugungsverfahren für Golderz (Reinheit von 75 % – 95 %) wird das Erz fein gemahlen und mit Cyanid im Verhältnis 1:1500 vermischt. Goldmetall wird gestapelt und mit einer Cyanidlösung im Verhältnis 1:1000 besprüht.
Normalerweise wird Gold durch Cyanid-Ionen komplexiert, um lösliche Derivate wie (Ag(CN)2) und (Au(CN)2) zu bilden. Silber wird üblicherweise in Form von Sulfid gefunden, in diesem Fall ist keine Redoxreaktion erforderlich, sondern eine Substitutionsreaktion mit der folgenden chemischen Formel:
- Ag2S + 4 NaCN + H2O → 2 Na(Ag(CN)2) + NaSH + NaOH
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na(Au(CN)2) + 4 NaOH
Zyanid kann zur Herstellung von CN-haltigen Verbindungen, üblicherweise Nitrilen, verwendet werden. Acylcyanide werden aus Acylchloriden und Cyanid hergestellt. Cyan ((CN)2), Chlorcyan (CNCl) und das Trimer Cyanurchlorid ((NCCl)3) werden aus Alkalimetallcyaniden gewonnen.
Die Zyanidverbindung Natriumnitroprussid (SNP) wird in der klinischen Chemie häufig zur Messung von Ketonkörpern im Urin (Nebenprodukte des Fettsäureabbaus) verwendet, hauptsächlich zur Überwachung des Blutzuckerspiegels bei Diabetikern und schwangeren Frauen. Manchmal wird es auch verwendet, um bei hypertensiven Notfällen zu helfen und als Vasodilatator in Studien zu Blutgefäßen. Darüber hinaus kann diese Verbindung die Behandlung von Tuberkulose und Lepra unterstützen.
In einigen Regionen wird Zyanid zur Bekämpfung von Schädlingen, Ameisen, Ratten usw. verwendet. Diese Verbindung muss jedoch genehmigt und in angemessenen Mengen verwendet werden, um die menschliche Gesundheit und die Umwelt nicht zu beeinträchtigen.
In ausreichender Menge kann Zyanid dazu beitragen, dass Bronzeskulpturen aufgrund ihrer blaufärbenden Eigenschaften schöner werden. Diese Verbindung wird auch bei der Herstellung von Schmuck und in der Fotografie verwendet. Darüber hinaus ist es ein wichtiger Bestandteil bei der Herstellung von Papier, Textilien und Kunststoffen. Bei der Ausführung dieser speziellen Arbeiten müssen Sie jedoch vollständige Schutzausrüstung tragen, um eine Zyanidvergiftung zu vermeiden.
In der Lebensmittelindustrie kann es zur Herstellung bestimmter Zusatzstoffe verwendet werden.
Zyanid ist eine vielseitige Verbindung, die viele Bereiche des Lebens beeinflusst, von der Industrie über die Landwirtschaft bis hin zu Dienstleistungen. Richtig angewendet, können sie einen positiven Beitrag zur Verbesserung der Lebensqualität und zur sozioökonomischen Entwicklung leisten. Zyanid ist eine Substanz, die anhand von Geruch und Geschmack schwer zu unterscheiden ist und häufig aus verschiedenen Quellen stammt, wie zum Beispiel:
In der Natur kommt Zyanid häufig in Luft, Wasser und Gesteinen vor. Sie kommen auch in einigen Lebensmitteln wie Mandeln, Sojabohnen, frischen Bambussprossen, frischer Maniok (Kassava), Äpfeln, Pflaumen, Pfirsichen usw. vor.
Die Cyanidgruppe (eine Gruppe mit der Summenformel CN) wurde im interstellaren Raum identifiziert. Dabei wird Cyan ((CN)2) zur Messung der Temperatur interstellarer Wolken verwendet.
Blausäure (H-C≡N) entsteht durch Thermolyse oder Verbrennung bestimmter Materialien unter sauerstoffarmen Bedingungen wie Abgasen von Verbrennungsmotoren und Zigarettenrauch. Darüber hinaus wird bei der Erhitzung oder Verbrennung bestimmter Kunststoffe, insbesondere solcher auf Acrylnitrilbasis (eine organische Verbindung mit der Formel CH2CHCN), Blausäure freigesetzt.
Gemäß der International Union of Pure and Applied Chemistry (IUPAC) werden organische Verbindungen mit der funktionellen Gruppe -C≡N als Nitrile bezeichnet, und Nitrile setzen normalerweise keine Cyanid-Ionen frei. Eine Hydroxylgruppe -OH und eine Cyanidgruppe -CN, die an dasselbe Kohlenstoffatom gebunden sind, werden als Cyanhydrin (R2C(OH)CN) bezeichnet, und Cyanhydrine können HCN freisetzen.

