السيانيد (Cyanide) مادة سامة خطيرة، يمكن أن تُهدد الحياة عند التعرض لجرعات عالية. إليك بعض المعلومات حول هذه المادة السامة:
يمكن أن يوجد السيانيد في حالات غازية وسائلة و صلبة. وهو مادة سامة عديمة اللون، لها رائحة تشبه رائحة اللوز المر، ولكن لا يمكن للجميع تمييز هذه الرائحة.
يشير مصطلح السيانيد عمومًا إلى المركبات التي تحتوي على رابطة كربون-نيتروجين (CN). بعض الأنواع شديدة السُمية ويمكن أن تُسبب الوفاة، وتشمل:
- السيانيد الغازي: كلوريد السيانوجين (CNCl)
- السيانيد الصلب: سيانيد الصوديوم (NaCN) وسيانيد البوتاسيوم (KCN)
- السيانيد السائل: سيانيد الهيدروجين (HCN)
يعمل السيانيد بسرعة كبيرة، حيث يمنع الجسم من استخدام الأكسجين، مما يؤدي إلى تلف الأعضاء الحيوية. إليك بعض الخواص الكيميائية لهذا المركب:
- السيانيد هو ملح لحمض السيانيك، وهو حمض أضعف من حمض الكربونيك (H2CO3)، لذلك يسهل إزاحته من محلول الملح بواسطة أحماض أقوى.
- الصيغة الكيميائية: 2NaCN + H2SO4 → Na2SO4 + 2HCN
- يتفاعل السيانيد مع الأكسجين في الهواء لتكوين سيانات.
- الصيغة الكيميائية: 2CN- + O2 → 2CNO-
- في المحلول المخفف بتركيز 1‰، يتحلل HCN تمامًا في غضون 5 أشهر تقريبًا.
- الصيغة الكيميائية: HCN + 2H2O → HCOONH4 and 2HCN + 2H2S + O2 → 2HCNS + 2H2O
- يتحلل ملح السيانيد القلوي بواسطة ثاني أكسيد الكربون في الهواء، وينتج عنه HCN.
- الصيغة الكيميائية: 2NaCN + CO2 + H2O → 2HCN + Na2CO3
- يمكن لأملاح السيانيد أن تذوب في الماء، وترتبط بسهولة مع السيانيد غير القابل للذوبان لتكوين أيونات معقدة. يمكن لحمض النيتريك (HNO3) أن يتفاعل مع المواد العضوية مثل حمض الماليك وحمض الستريك والقلويات والتاين… لإنتاج سيانيد الهيدروجين (HCN). وهذا ما يفسر آلية تكوين الجلوكوزيدات السيانيدية في بعض النباتات.
- يمكن للألدهيدات (المركبات الموجودة في الكحول) والسكريات أيضًا تدمير بنية HCN.
- الصيغة الكيميائية: C6H12O6 + HCN → C7H13O6N
- توجد مشتقات عضوية من حمض السيانيدريك (HCN) في بعض النباتات مثل اللوز المر، وبذور البرقوق، وجذور الكسافا، والخيزران… على سبيل المثال، الأميغدالين (C20H27NO11 – مادة كيميائية طبيعية موجودة في بعض النباتات) الموجود في زيت اللوز المر، عند التحلل المائي، سيطلق HCN.
- الصيغة الكيميائية: C20H27NO11 + 2H2O → C7H6O + 2C6H12O6 + HCN

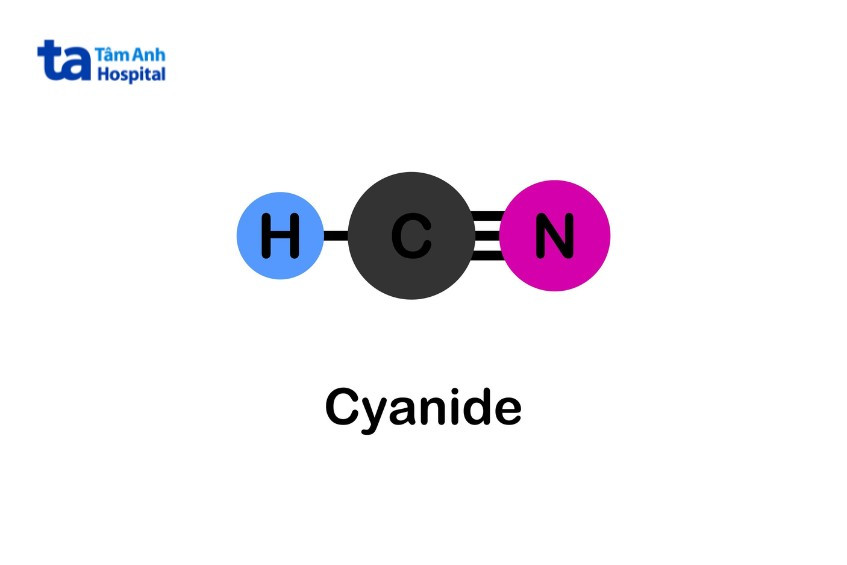




السيانيد قاعدي، وقيمة PKa لسيانيد الهيدروجين هي 9.1. لذلك، عند إضافة حمض قوي إلى محلول ملح السيانيد، يتم إطلاق سيانيد الهيدروجين. يخضع هذا المركب للتحلل المائي لتكوين الأمونيا (NH3) والفورمات (HCOO-). بالمقارنة مع السيانيد الأصلي، فإن هذه المنتجات أقل سُمية.
- الصيغة الكيميائية: CN- + 2 H2O → HCOO- + NH3
أنيون السيانيد له قدرة عالية على استقبال الإلكترونات، لذلك يمكن لمجموعات السيانيد أن تحل محل مجموعات الهاليد بسهولة للدخول في الجزيئات العضوية. في الخلائط العضوية، يعتبر السيانيد مركبًا من C-1، ويُستخدم لإطالة سلسلة الكربون، مع الحفاظ على وظائفها.
- الصيغة الكيميائية: RX + CN- → RCN + X-
أيون السيانيد عامل مختزل ويمكن أن يتأكسد بواسطة عوامل مؤكسدة قوية مثل الكلور (Cl2) والهيبوكلوريت (CIO-) وبيروكسيد الهيدروجين (H2O2). في عمليات تعدين الذهب، تُستخدم هذه المواد المؤكسدة عادةً لإذابة السيانيد السام في مياه الصرف الصحي، لحماية النظام البيئي من التلوث.
يتفاعل أنيون السيانيد مع المعادن الانتقالية لتكوين رابطة M-CN (سيانوميتالات أو سيانوميتال)، وهذا التفاعل هو أساس سُمية السيانيد. يمكن أن يكون انجذاب المعدن القوي لهذا الأنيون ناتجًا عن عوامل مثل الشحنة السالبة والكثافة والقدرة على المشاركة في رابطة π.
عملية أندروسوف هي العملية الرئيسية لإنتاج السيانيد. حيث يتم إنتاج المادة السامة في شكل غازي من الميثان (CH4) والأمونيا (NH3) في وجود الأكسجين وعامل حفاز البلاتين.
- الصيغة الكيميائية: 2CH4 + 2NH3 + 3O2 → 2HCN + 6H2O
سيانيد الصوديوم هو مقدمة لمعظم أنواع CN، ويتم إنتاجه عن طريق تفاعل هيدروكسيد الصوديوم مع سيانيد الهيدروجين.
- الصيغة الكيميائية: HCN + NaOH → NaCN + H2O
على الرغم من كونه مادة شديدة السمية، إلا أن السيانيد لا يزال يُستخدم في العديد من المجالات مثل:
تساعد هذه المادة السامة في إذابة وفصل الذهب والفضة عن الشوائب الأخرى. في عملية معالجة خام السيانيد، بالنسبة لخام الذهب (بنسبة نقاء 75٪ – 95٪)، يتم طحنه وخلطه مع السيانيد بنسبة 1: 1500. بالنسبة لخام معدن الذهب، يتم تكديسها معًا ورش محلول السيانيد بنسبة 1: 1000.
عادةً ما يتم معقدة الذهب بواسطة أيون السيانيد لتكوين مشتقات قابلة للذوبان مثل (Ag(CN)2) و (Au(CN)2). غالبًا ما يوجد الفضة على شكل كبريتيد، في هذه الحالة لا حاجة لتفاعل أكسدة واختزال، بل هو تفاعل إحلال بالصيغة الكيميائية التالية:
- Ag2S + 4 NaCN + H2O → 2 Na(Ag(CN)2) + NaSH + NaOH
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na(Au(CN)2) + 4 NaOH
يمكن استخدام السيانيد لإنتاج مركبات تحتوي على CN، عادةً النتريلات. يتم إنتاج أسيل السيانيد من الأسيل والسيانيد. ينتج السيانوجين ((CN)2) وكلوريد السيانوجين (CNCl) وثلاثي كلوريد السيانوريك ((NCCl)3) من سيانيد المعدن القلوي.
يُستخدم مركب نيتروبروسيد الصوديوم السيانيد (SNP) عادةً في الكيمياء السريرية لقياس أجسام الكيتون في البول (ناتج ثانوي لتحلل الأحماض الدهنية)، ويُستخدم بشكل رئيسي في مراقبة نسبة السكر في الدم لدى مرضى السكري والنساء الحوامل. في بعض الأحيان، يُستخدم أيضًا للمساعدة في خفض ضغط الدم بشكل طارئ ويُستخدم كعامل موسع للأوعية في الدراسات الوعائية. بالإضافة إلى ذلك، يمكن لهذا المركب أن يساعد في علاج السل والجذام.
في بعض المناطق، يُستخدم السيانيد للقضاء على الآفات والحشرات والفئران… ومع ذلك، يجب ترخيص هذا المركب واستخدامه بكميات مناسبة حتى لا يؤثر على صحة الإنسان ولا يضر بالبيئة.
بكمية مناسبة، يمكن للسيانيد أن يجعل المنحوتات البرونزية تبدو أجمل بفضل قدرته على خلق لون أزرق. يُستخدم هذا المركب أيضًا في صناعة المجوهرات والتصوير الفوتوغرافي. بالإضافة إلى ذلك، فهو أحد المكونات المهمة في عملية إنتاج الورق والنسيج والبلاستيك. ومع ذلك، عند القيام بهذه الأعمال المتخصصة، يجب عليك استخدام معدات واقية كاملة لتجنب التسمم بالسيانيد.
في صناعة الأغذية، يمكن استخدامه لإنتاج بعض المواد المضافة.
السيانيد مركب متعدد الاستخدامات، يؤثر على العديد من مجالات الحياة، من الصناعة والزراعة إلى الخدمات. إذا طُبق بشكل صحيح، فيمكن أن يُساهم بشكل إيجابي في تحسين نوعية الحياة والتنمية الاجتماعية والاقتصادية. السيانيد مادة يصعب تمييزها من خلال الرائحة والطعم وغالبًا ما توجد من مصادر مختلفة مثل:
في الطبيعة، يوجد السيانيد عادةً في الهواء والماء والصخور. كما أنه موجود في بعض الأطعمة مثل اللوز وفول الصويا والخيزران الطازج والكسافا الطازجة (البطاطا الحلوة) والتفاح والبرقوق والخوخ…
تم تحديد جذر السيانيد (جذر له الصيغة الجزيئية CN) في الفضاء بين النجوم. حيث يُستخدم السيانوجين (CN)2 لقياس درجة حرارة السحب بين النجوم.
ينتج سيانيد الهيدروجين (H−C≡N) عن التحلل الحراري أو احتراق بعض المواد في ظروف نقص الأكسجين مثل عادم محركات الاحتراق الداخلي ودخان السجائر. بالإضافة إلى ذلك، عند تسخين أو حرق بعض أنواع البلاستيك، وخاصة تلك المشتقة من الأكريلونيتريل (مركب عضوي له الصيغة CH2CHCN)، فإنها ستطلق سيانيد الهيدروجين.
وفقًا للاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC)، فإن جميع المركبات العضوية التي تحتوي على المجموعة الوظيفية −C≡N تسمى النتريلات، وعادةً لا تطلق النتريلات أيونات السيانيد. بينما تسمى المجموعة الوظيفية الهيدروكسيل −OH والسيانيد −CN المرتبطة بنفس ذرة الكربون بالسيانوهيدرين (R2C(OH)CN) ويمكن للسيانوهيدرين أن يطلق HCN.
