Xyanua (Cyanide) là chất độc nguy hiểm, có thể gây hại đến tính mạng nếu tiếp xúc với liều cao. Dưới đây là những thông tin về chất độc này:
Xyanua có thể tồn tại dưới các dạng khí, lỏng và rắn. Đây là chất độc không màu, có mùi gần giống quả hạnh nhân, nhưng không phải ai cũng phân biệt được mùi này.
Xyanua là thuật ngữ chung để chỉ các hợp chất chứa liên kết carbon-nitrogen (CN). Một số dạng có độc tính cao, có thể gây tử vong gồm:
- Dạng khí: Xyanogen clorua (CNCl)
- Dạng rắn: Natri xyanua (NaCN) và kali xyanua (KCN)
- Dạng lỏng: Hydro cyanide hay thường gọi hydro xyanua (HCN)
Xyanua có tác dụng rất nhanh, có khả năng ngăn cản cơ thể sử dụng oxy, dẫn đến tổn thương các cơ quan quan trọng. Một số tính chất hóa học của hợp chất này:
- Xyanua là muối của axit xyanic, một axit yếu hơn cả axit cacbonic (H2CO3), nên dễ bị các axit mạnh hơn đẩy ra khỏi dung dịch muối của nó.
- Công thức hóa học: 2NaCN + H2SO4 → Na2SO4 + 2HCN
- Xyanua phản ứng với oxy trong không khí để tạo thành cyanat.
- Công thức hóa học: 2CN- + O2 → 2CNO-
- Ở dung dịch loãng có nồng độ 1‰, HCN bị phân hủy hết trong khoảng 5 tháng.
- Công thức hóa học: HCN + 2H2O → HCOONH4 và 2HCN + 2H2S + O2 → 2HCNS + 2H2O
- Muối kim loại kiềm xyanua bị CO2 trong không khí phân hủy và tạo thành HCN.
- Công thức hóa học: 2NaCN + CO2 + H2O → 2HCN + Na2CO3
- Các muối xyanua có thể tan trong nước, dễ dàng liên kết với xyanua không tan để tạo thành các ion phức. Axit nitric (HNO3) có thể tác dụng với các chất hữu cơ như axit malic, citric, ancaloit, tanin… để sản sinh ra hydro xyanua (HCN). Điều này giải thích cơ chế hình thành các glucoside cyanhydric ở một số loài thực vật.
- Các aldehyde (hợp chất có trong rượu) và đường cũng có khả năng phá hủy cấu trúc HCN.
- Công thức hóa học: C6H12O6 + HCN → C7H13O6N
- Các dẫn xuất hữu cơ của axit xyanhydric (HCN) được tìm thấy trong một số loài thực vật như hạnh nhân đắng, hạt mận, rễ sắn, măng… Ví dụ, amygdalin (C20H27NO11 – chất hóa học tự nhiên được tìm thấy trong một số loài thực vật) có trong dầu hạnh nhân đắng khi thủy phân sẽ giải phóng HCN.
- Công thức hóa học: C20H27NO11 + 2H2O → C7H6O + 2C6H12O6 + HCN

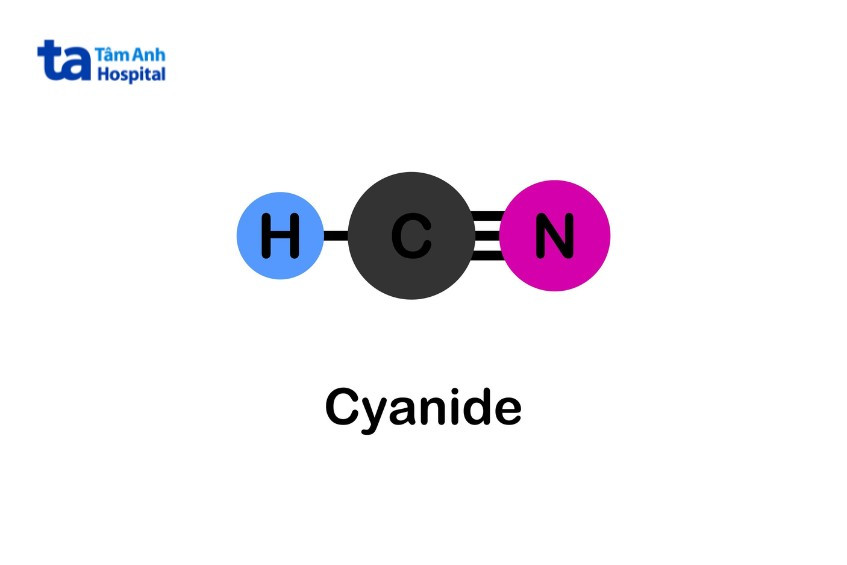




Xyanua có tính bazo, PKa của hydro xyanide là 9,1. Do đó, khi thêm axit mạnh vào dung dịch muối xyanua thì sẽ giải phóng hydro xyanua. Hợp chất này trải qua quá trình thủy phân để tạo ra amoniac (NH3) và formate (HCOO-). So với xyanua ban đầu, các sản phẩm này có độc tố thấp hơn.
- Công thức hóa học: CN- + 2 H2O → HCOO- + NH3
Anion xyanua có tính ái nhân cao, do đó các nhóm xyanua dễ dàng thay thế nhóm halide để đi vào các phân tử hữu cơ. Trong hỗn hợp hữu cơ, xyanua là một synthon C-1, được sử dụng để kéo dài chuỗi carbon, trong khi vẫn giữ được các chức năng của nó.
- Công thức hóa học: RX + CN- → RCN + X-
Ion xyanua là chất khử và có thể bị oxy hóa bởi các tác nhân có tính oxy hóa cao như clo (Cl2), hypoclorit (CIO-) và hydro peroxide (H2O2). Trong hoạt động khai thác vàng, người ta thường sử dụng các chất oxy hóa này để hòa tách xyanua độc trong nước thải, bảo vệ hệ sinh thái khỏi sự ô nhiễm.
Anion xyanua phản ứng với kim loại chuyển tiếp để tạo thành liên kết M-CN (Cyanometallate hoặc cyanometalate), phản ứng này là cơ sở của độc tính xyanua. Tính ái lực cao của kim loại đối với dạng anion này có thể đến từ các yếu tố như điện tích âm, độ chặt và khả năng tham gia vào liên kết π.
Andrussow là quy trình chính để sản xuất xyanua. Trong đó chất độc dạng khí được sản xuất từ metan (CH4) và amoniac (NH3) trong môi trường có oxy và chất xúc tác platin.
- Công thức hóa học: 2CH4 + 2NH3 + 3O2 → 2HCN + 6H2O
Natri xyanua là tiền chất của hầu hết các loại CN, nó được sản xuất bằng cách cho natri hydroxit và hydro xyanua tác dụng với nhau.
- Công thức hóa học: HCN + NaOH → NaCN + H2O
Mặc dù được biết đến là một chất cực độc, nhưng xyanua vẫn được ứng dụng trong nhiều lĩnh vực như:
Chất độc này giúp hòa tan và tách vàng, bạc khỏi các tạp chất khác. Trong quy trình xyanua hóa quặng, đối với quặng vàng (độ tinh khiết đạt 75% – 95%), người ta sẽ nghiền mịn và trộn cùng xyanua với tỷ lệ 1:1500. Đối với quặng kim loại vàng, chúng được xếp lại với nhau và phun dung dịch xyanua lên với tỷ lệ 1:1000.
Thông thường, vàng được phức hợp bởi ion xyanua để tạo thành các dẫn xuất hòa tan như (Ag(CN)2) và (Au(CN)2). Bạc thường được tìm thấy dưới dạng sunfua, trường hợp này không cần phản ứng oxy hóa khử, thay vào đó là phản ứng thế với công thức hóa học sau:
- Ag2S + 4 NaCN + H2O → 2 Na(Ag(CN)2) + NaSH + NaOH
- 4 Au + 8 NaCN + O2 + 2 H2O → 4 Na(Au(CN)2) + 4 NaOH
Xyanua có thể được ứng dụng để sản xuất các hợp chất chứa CN, thường là nitrile. Acyl xyanua được sản xuất từ acyl và xyanua. Xyanogen ((CN)2), xyanogen clorua (CNCl) và trimer xyanuric clorua ((NCCl)3) có nguồn gốc từ xyanua kim loại kiềm.
Hợp chất xyanua natri nitroprusside (SNP) thường được sử dụng trong hóa học lâm sàng để đo thể ketone trong nước tiểu (sản phẩm phụ của sự phân hủy axit béo), chủ yếu dùng trong theo dõi chỉ số đường huyết của người bệnh tiểu đường và phụ nữ mang thai. Đôi khi, nó cũng được dùng để giúp làm giảm huyết áp khẩn cấp và sử dụng như một chất giãn mạch trong các nghiên cứu về mạch máu. Ngoài ra, hợp chất này còn có khả năng hỗ trợ điều trị bệnh lao và bệnh phong.
Ở một số vùng, xyanua được sử dụng để tiêu diệt sâu bệnh, kiến, chuột… Tuy nhiên, hợp chất này cần được cấp phép và sử dụng với định lượng vừa đủ để không ảnh hưởng đến sức khỏe con người và không gây hại đến môi trường sống.
Với một lượng vừa đủ, xyanua có thể giúp các tác phẩm điêu khắc bằng đồng trở nên đẹp hơn nhờ khả năng tạo sắc xanh. Hợp chất này cũng được dùng trong chế tác đồ trang sức và chụp ảnh. Ngoài ra, nó là một trong những thành phần quan trọng trong quy trình sản xuất giấy, vải và nhựa. Tuy nhiên, khi thực hiện các công việc đặc thù này, bạn cần sử dụng đồ bảo hộ đầy đủ để tránh nhiễm độc xyanua.
Trong ngành công nghiệp thực phẩm, nó có thể được sử dụng để sản xuất một số chất phụ gia.
Xyanua là một hợp chất đa năng, có ảnh hưởng đến nhiều lĩnh vực trong cuộc sống, từ công nghiệp, nông nghiệp cho đến dịch vụ. Nếu được ứng dụng đúng cách, chúng có thể đóng góp tích cực trong việc nâng cao chất lượng cuộc sống và phát triển kinh tế – xã hội. Xyanua là một chất khó phân biệt thông qua mùi vị và thường được tìm thấy từ nhiều nguồn khác nhau như:
Trong tự nhiên, xyanua thường tồn tại trong không khí, nước và đất đá. Chúng cũng được tìm thấy ở một số thực phẩm như hạnh nhân, đậu nành, măng tươi, sắn tươi (khoai mì), táo, mận, đào…
Gốc xyanua (một gốc có công thức phân tử CN) đã được xác định trong không gian giữa các vì sao. Trong đó, cyanogen (CN)2 được sử dụng để đo nhiệt độ của các đám mây giữa các vì sao.
Hydro xyanua (H−C≡N) được tạo ra do quá trình nhiệt phân hoặc đốt cháy một số vật liệu trong điều kiện thiếu oxy như khí thải của động cơ đốt trong, khói thuốc lá. Ngoài ra, khi đun nóng hoặc đốt cháy một số loại nhựa, đặc biệt là những loại có nguồn gốc từ acrylonitrile (hợp chất hữu cơ có công thức là CH2CHCN), chúng sẽ giải phóng hydro xyanua.
Theo International Union of Pure and Applied Chemistry (IUPAC, liên minh quốc tế về hóa học cơ bản và hóa học ứng dụng), các hợp chất hữu cơ có nhóm chức −C≡N đều được gọi là nitrile và nitrile thường không giải phóng các ion xyanua. Trong khi đó, một nhóm chức thuộc hydroxyl −OH và xyanua −CN liên kết với cùng một nguyên tử cacbon thì được gọi là cyanohydrin (R2C(OH)CN) và cyanohydrin có thể giải phóng HCN.

